Maddelerdeki karışımları ayırma yöntemleri arasında her ne kadar da fiziğin konusu olsa da günlük hayatımızda sıkça karşımıza çıkan bir durumdur. Peki, karışımlardaki maddeler nasıl ayrılır? Maddeleri ayırma yöntemleri nelerdir? İşte merak edilenler ve detaylar!
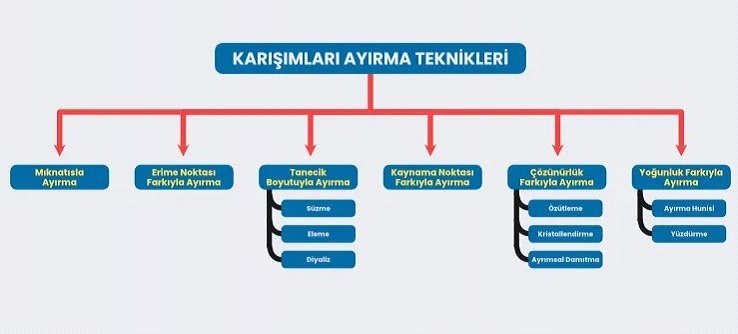
Karışımları meydana gelen maddeler, genellikle kendi özelliklerini kaybetmeden bir araya gelir. Belirli şekillerde de kendi özelliklerine dönerek ayrışabilir. Karışımların nasıl ayrışacağı bu noktada merak edilmektedir. Karışımların özelliklerine göre ayırmak için hangi metodun kullanacağına karar verilir. Karışımların özelliklerine göre tercih edilebilen karışımları ayırma yöntemleri şu şekilde sıralanabilir:
Karışımları ayırmada en sık kullanılan ve en çok bilinen yöntemlerden biri de mıknatıs ile ayırmadır. Mıknatıs ile ayırma yöntemi sanılanın aksine çok kolay ve pratiktir. Mıknatıs demir, nikel ve kobalt metallerini çeker. Bu elementlerden oluşan karışımlar yakınlarına mıknatıs geldiği zaman hemen ayrışabilir. Mıknatıs ile ayırma bu şekilde olmaktadır. Özellikle kağıt enstitüsünde metallerin ayrıştırılması için bu yöntem tercih edilmektedir.
Erime noktası farkı ile maddeleri ayrıştırma yöntemi özellikle alaşım ve homojen katı-katı karışımlara örnek olarak gösterilebilir. Örnek vermek gerekirse kalay ve çinko maddelerinden oluşan karışım ısıtıldığı zaman erime noktası küçük olan çinko metali karışımından kolayca ayrılmaktadır. Bununla birlikte altın ve bakır karışımlarının da bu yöntem ile ayrıştığı bilinmektedir.
Tanecik boyutu ile karışımları ayırma yönteminde özellikle süzme, eleme ve diyaliz yöntemleri tercih edilmektedir. Bu yöntemleri de tek tek şu şekilde açıklayabiliriz:
Özellikle kanın metabolik atıklardan temizlenmesi, proteinin geçemeyerek kanda kalması örneği ile durum açıklanabilir.
Kaynama noktası farklı ile karışımları ayırma özellikle sıvı sıvı homojen karışımların bileşenlerine ayrıştırılması için tercih edilmektedir. Ayrımsal damıtma yöntemi ile yapılan bu işlemde örnek olarak etil alkol su, su ham petrol ayrıştırılması örnek gösterilebilir. Isıtılan karışım içerisinde kaynama noktası düşük olan karışım önce buharlaşmaktadır. Gaz fazına geçen sıvı soğutma kabında soğutularak yoğunlaşır ve toplama kabında birikir.
Bunun dışında tuzlu su karışımında suyun buharlaştırılıp toplama kabında biriktirilmesi işlemine basit damıtma denilmektedir. Damıtlama işleminin sonucunda toplama kabında biriken sıvıya destilant ismi verilmektedir. Katı ve sıvı homojen karışımlarda, karışımdaki sıvının kaynatılıp daha sonra soğutularak yoğunlaştırılmasına ise damıtma işlemi adı verilmektedir.
Bu ayrıştırma için ise etil alkol su, su ham petrol, tuzlu su örnekleri verilebilir.
Maddeleri ayırma konusunda çözünürlük farkı ile ayırma da önemli bir yer tutmaktadır. Maddelerin katı, sıvı ve gaz hallerinde çözünürlük ayırt edici özelliktir. Bu özellik ile bazı karışımlar birbirinden ayrılabilir. Çözünürlük farkı ile ayırma dediğimiz zaman “Özütleme”, “Kristallendirme” ve “Ayrımsal Damıtma” konularını da ayrı ayrı incelememiz gerekmektedir.
Özütleme, çözünürlük farkı ile ayırma konusu içerisinde işlenmektedir. Özütleme, karışımlardaki bileşenlerden birini uygun bir çözücü içerisinde seçici bir şekilde çözüp ayırma işlemi olarak tanımlanmaktadır. Bu işleme ise fizik alanında özütleme denilmektedir.
Kristallendirme işlemi, maddenin çözünmüş halinde iken kristal yapılı katı hale geçiş sürecine kristalleştirme denilmektedir. Örnek vermek gerekirse, sıvı ve katı komojen çözelti içerisinde çözeltinin ısıtılarak çözücüsünün buharlaştırılması ya da çözeltinin soğutulmasıyla çözünen katının çökelmesine kristallendirme denilmektedir.
Çözünürlük farkı ile ayırma başlığı altında inceleyeceğimiz son karışımların ayırma teknikleri içerisinde ayrımsal damıtma bulunmaktadır. Ayrımsal kristallendirme olarak da ifade edilen bu işlem içersinde aynı çözücü içerisinde çözülen iki katı maddenin çözünürlük sıcaklıkla değişimlerinin farklı olmasından yola çıkılarak yapılan ayırma işlemine denilmektedir. Sıcaklık içerisinde çözünürlükleri farklı miktarda olan iki katının ayrılması için kullanılmaktadır.
Yoğunluk farkı ile ayırma da karışımları ayırma teknikleri arasında bulunmaktadır. Özellikle heterojen karışımlar yoğunluk farklı ile ayrışabilir. Bu başlık altında da 2 ayrıştırma tekniği bulunmaktadır.
Birbiri içerisinde çözülemeyen ve öz kütleleri farklı olan 2 karışımın ayırması için kullanılmaktadır. Genellikle sıvı sıvı heterojen karışımların ayrılması için kullanılır. Örnek olarak yağ ve su karışımını verebiliriz.
Karışımları ayırma teknikleri içerisinde son olarak yüzdürme tekniğinden bahsedebiliriz. Flotasyon olarak da adlandırılan yüzdürme tekniği, katı katı heterojen katışımlarının bileşenlerinden biri sıvı yardımı ile sıvının yüzeyine çıkarılarak ayrılmasına denilmektedir. Bu işlemin yapılabilmesi için bileşenlerin sıvı içerisinde çözünmemesi gerekiyor. Bunun dışında bileşenlerden birinin sıvıdan ağır, diğerinin de hafif olması gerekmektedir. Sudan yoğunluğu az olan madde su yüzeyine çıkacaktır. Yüzeyden ayrılması ile diğer karışımdan ayrılacaktır.

Karışımları ayırma teknikleri görüldüğü üzere çok sayıda alt başlığı olan konular arasında bulunmaktadır. Bu konuyu iyi bir şekilde kavrayabilmek adına bilinmesi gereken bazı terimler bulunmaktadır. O terimlerden bazıları açıklamaları ile birlikte şu şekilde:
Fizik, kimya ve coğrafya alanında sıkça kullanılan bir terimdir. Bir sıvının içerisinde gazın dağılması ya da bir katının içerisinde gaz dağılması ile meydana gelmektedir. Bu duruma örnek vermek gerekirse, verebileceğimiz en iyi örnek sis ve duman olacaktır. Dumanın içerisinde gözle göremeyeceğimiz kadar küçük katı tanecikler bulunmaktadır. Bu tanecikler havanın içerisinde dağılmıştır. Günlük hayat içerisinde ise cam temizleyici, parfüm, deodorantlar aerosollere örnektir.
Sıkça duyulan ancak anlamının karıştırıldığı emülsiyon da karışımları ayırma teknikleri arasında bulunmaktadır. Birbiri içerisinde karışmayan iki sıvı heterojenin karışması ile oluşmaktadır. Aralarındaki faz farkı görülür. Örnek vermek gerekirse su zeytinyağı, su ve benzin karışımları örnek gösterebilmektedir.
Dışarıdan bakıldığı zaman bir kolloid homojen bir görünüme sahiptir. Bir maddenin sıvı içerisinde asılı kalması ile oluşmaktadır.
Katı ve sıvı karışımı olan heterojen karışımlar süspansiyon olarak adlandırılmaktadır. Bu karışımlar hakkında aslında bilmeniz gereken en önemli özellik, çözelti olmadıklarıdır.
Kimya alanında sıkça karşımıza çıkan ancak karıştırılması da çok muhtemel olan 2 kavramdan bahsetmek istiyoruz. Heterojen ve homojen karışımlar.. Bu karışımların benzerlikleri ve farklılıklarını aşağıda tablo içerisinde açıkladık:
| HETEROJEN KARIŞIMLAR | HOMOJEN KARIŞIMLAR |
| Bileşenleri tamamen karışmaz | Bileşenleri tamamen karışır, çözeltidir |
| Karışmayan maddeler dışarıdan görülebilir | Bileşenleri tamamen karışır, tek faz gibi görünür |
| Beklenirse, çökelti oluşumu görülür | Beklenirse çökelme olayı görülmez |
| Süzgeç kağıdı kullanılırsa, kağıt tıkanır | Gaz ve sulu çözeltiler süzgeç kağıdından geçer |
| Katı, sıvı ya da gaz halindedirler | Katı, sıvı ya da gaz olabilir |
| Bulanık bir görüntüsü olabilir | Gaz ve sulu çözeltiler saydam bir formdadır |
| Kumlu su, yağlı su, sis ve duman örnektir | Hava, sirke, şekerli su, yağmur suyu örnektir |
Heterojen karışımları ayırma için 3 ana başlığı ele almamız gerekiyor. Bu yöntemlerin aynı zamanda ayrı başlıkları da bulunmaktadır:
Homojen karışımları ayırma yöntemlerinin içerisinde de 2 önemli başlık bulunmaktadır. İşte o başlıklar ve alt maddeleri:
Belirttiğimiz gibi karışımlar yukarıda ifade ettiğimiz üzere maddelerin yapısına ve özelliğine göre diğer maddelerden ayrılmaktadır. Homojen ve heterojen karışımlarda da ayırma yöntemleri aslında karışımlardaki madde yapılarına göre farklılık gösterebilmektedir.