Rus kimyacı D. Mendeleyev (D. Mendelyef) elementler için çok kapsamlı bir sistem önermiştir. Bu sistem düzgün ve periyodik olarak tekrarlanan özellikleri temel almıştır.
Mendeleyev’in periyodik sisteminde elementlerin özelliklerine göre çok doğru bir şekilde gruplandırılması ve keşfedilmemiş bazı elementlerin yerlerinin boş bırakılarak özelliklerinin tahmin edilmesi, o zamana kadar yapılan çalışmalara üstünlük sağlamıştır.
Örneğin alüminyum elementinin altında bulunan galyum elementinin özellikleri henüz element keşfedilmeden biliniyordu. 1870 yılından 1913 yılına kadar geçerliliğini koruyan Mendeleyev’in periyodik sisteminde elementler atom kütlelerine göre yatay ve düşey sıralar hâlinde düzenlenmiştir. Mendeleyev ilk kez grup kavramını kullanmıştır ve 63 elementi 12 yatay sıra (periyot) ve 8 dikey sıra (grup) olarak düzenlemiştir. Aynı gruptaki elementlerin fiziksel ve kimyasal özelliklerinin benzediğini ve periyodik olarak değiştiğini söylemiştir.
İçindekiler
Mendeleyev’in periyodik sistemi geçerliliğini kırk yıldan fazla sürdürse de kendi içinde bazı tutarsızlıklar içeriyordu. Örneğin bir asal gaz olan argonun atom kütlesi 39,95, potasyumun atom kütlesi ise 39,10 olarak biliniyordu. Sadece atom kütlelerine bakılarak bir düzenleme yapılsaydı argon, bugünkü potasyumun yerinde olurdu. Ancak hiçbir kimyacı bir asal gaz olan argonu, çok etkin metaller olan lityum ve sodyum gibi metallerin grubuna yerleştirmemiştir. Mendeleyev bunu, atom kütlelerinin ölçümünde hata olabileceğini düşünerek yorumluyordu.
1913 yılında Henry Moseley, yüksek enerjili elektronlarla bombardıman edilen elementlerin ürettiği X ışınlarının frekansları ile atom numaraları arasında bir bağıntı olduğunu keşfetti. Her elementin çekirdeğinde bulunan proton sayısını (atom numarası) tespit eden Moseley, elementleri atom numaralarına göre sıraladığında -birkaç element haricinde- bu sıralamanın, atom kütlesi artışına göre yapılan sıralama ile uyumlu olduğunu gördü. Atom numarası artışına göre sıralanan elementlerde 18Ar elementinden sonra 19K elementi geliyordu. Bu durum, Mendeleyev’in periyodik sistemindeki tutarsızlılıkları gideriyordu.
Elementler, Moseley’in önerdiği gibi atom numaralarının artışına ve benzer özelliktekiler alt alta gelecek şekilde sıralandığında, elementlerin yatay veya dikey sıralarda belirli özelliklerinin periyodik olarak genelde düzenli bir şekilde değiştiği gözlenmiştir.
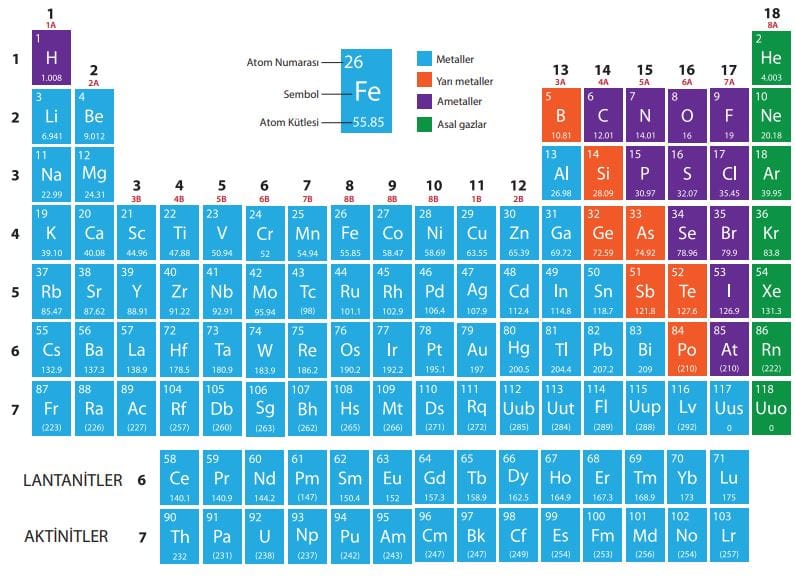
Periyodik sistemde her element bir kutu içerisinde gösterilirken metal, ametal, yarı metal, asal (soy) gazlar veya belirli özelliklerine göre renkler kullanılabilir.
Basit bir periyodik sistemde elementin sembolü, atom numarası ve kütle numarası gösterilirken daha ayrıntılı periyodik sistemlerde elementin erime noktası, kaynama noktası, özkütlesi, elektron dizilimi, alabileceği yükseltgenme basamakları gibi özellikler de görülebilir.

Yukarıda görülen periyodik çizelgede element sembolü, atom numarası, atom kütlesi verilmiş; periyot ve grup numaraları yazılarak çeşitli özelliklerine göre de renklendirmeler yapılmıştır.
Periyodik tabloda yatay sıralara periyot , dikey sütunlara ise grup adı verilir. Aynı periyotta olan elementlerin fiziksel veya kimyasal özellikleri birbirine benzemezken bazı özellikler periyodik olarak değişir. Aynı grupta olan elementlerin fiziksel ve kimyasal özellikleri benzerdir. Gruplarda da bazı özellikler periyodik olarak değişir.
Periyodik sistemde eski sisteme göre gruplar A ve B grupları olarak sınıflandırılmış ve toplam 18 grup belirlenmiştir. 8B olarak adlandırılan 3 tane grup vardır. Ancak yeni uygulanan sisteme göre gruplardaki A ve B sınıflandırılması kalkmıştır. Periyodik sistemdeki gruplar, 1. grup olarak başlanıp 18. gruba kadar numaralandırılmıştır. Günümüzde her iki sistem de kullanılmaktadır. Cetveldeki A gruplarına baş (ana) grup , B gruplarına ise yan grup denir.
Gruplarda ve periyotlarda farklı sayılarda elementler bulunabilir. 1. periyotta hidrojen (H) ve helyum (He) olmak üzere sadece iki element varken 2 ve 3. periyotlarda sekizer, 4 ve 5. periyotlarda on sekizer, 6 ve 7. periyotlarda ise otuz ikişer element bulunur.
Gruplardaki elementlerin fiziksel ve kimyasal özelliklerinin birbirine benzemesinin sebebi, son enerji düzeylerinde genelde aynı sayıda elektron bulunmasıdır. Son enerji düzeyindeki elektron sayıları eşit olan elementler kimyasal tepkimelerde benzer kimyasal özellikler gösterir.
Periyodik sistemde bazı grupların özel adları vardır. 1. grup elementlerine alkali metaller grubu (Hidrojen ametaldir.), 2. grup elementlerine toprak alkali metaller grubu, 13. grup elementlerine toprak grubu, 17. grup elementlerine halojenler, 18. grup elementlerine asal (soy) gazlar denir.
Periyodik sistemde 57La elementinden sonra gelen 14 element lantanitler, 89Ac elementinden sonra gelen 14 element ise aktinitler olarak adlandırılır. Bohr atom modeline göre tek elektronlu atomlardaki bir elektron farklı enerji düzeyinde bulunabilir. Bohr, çok elektronlu atom ve iyonların davranışlarını açıklamasa da biz atomun elektronlarının davranışlarının anlaşılması açısından çok elektronlu atomların katman-elektron dağılımlarını da Bohr atom modeline göre belirleyeceğiz. Her elementin periyodik sistemdeki yeri ile katman-elektron dağılımı arasında bir ilişki vardır.
Öncelikle katman-elektron dağılımlarının yazılmasını anlayarak atomların periyodik sistemdeki yerlerinin katman-elektron dağılımlarına göre bulunmasını öğrenelim.
Katman-elektron dağılımlarında Pauli prensibi geçerlidir. Pauli prensibine göre enerji düzeylerinde bulunabilecek en fazla elektron sayısı sabittir. Enerji düzeyi sayısı n olmak üzere her katman en çok 2n2 tane elektron bulundurabilir.
Enerji düzeylerindeki en fazla elektron sayısının hesaplanması için geçerli olan 2n2 formülü ilk dört enerji düzeyi için geçerlidir. Aşağıdaki tabloda ilk dört enerji düzeyinin bulundurabileceği en çok elektron sayıları görülmektedir.

Neon (10Ne) element atomunun çekirdeğinde on tane proton ve enerji düzeylerinde de on tane elektron bulunur. Birinci enerji düzeyinde en fazla iki, ikinci enerji düzeyinde de en fazla sekiz elektron bulunabileceğinden neon atomunun katman-elektron dağılımı aşağıda görüldüğü gibi olur.

Atom numarası 11 olan sodyum (Na) ve 18 olan argon (Ar) element atomlarının katman-elektron dağılımı aşağıda verilmiştir.

Element atomlarının katman-elektron dağılımı yazılmasında aşağıdaki kurallar geçerlidir:
Bir atom veya iyonun katman-elektron dağılımı farklı şekillerde gösterilebilir. Şekilde 16S element atomunun katman-elektron dağılımı farklı şekillerde [(a), (b), (c)] gösterilmiştir.

Periyodik sistemde 7 tane periyot ve 18 tane grup olduğunu biliyoruz. Bir elementin periyodik sistemdeki yerinin belirlenmesi periyot ve grup numarasının bilinmesi ile olur.
Elementler periyodik sistemde proton sayılarına göre dizilmişlerdir. Elementin periyot ve grup numarasının bulunabilmesi için katman-elektron dağılımının yazılması gerekir. Nötr atomlarda proton sayısı elektron sayısına eşit olduğundan proton sayısına göre katman-elektron dağılımı yazılabilir.
Katman-elektron dağılımına göre periyot ve grup numarası bulmak için aşağıdaki kurallar geçerlidir:
Son enerji düzeyinde bulunan elektron sayısı eski sisteme göre grup numarasını verir. Ancak yeni sisteme göre grup numarası belirlerken 10 ekleme kuralı uygulanır. Son enerji düzeyinde 1 ve 2 elektron varsa sırası ile 1A (1. grup) ve 2A (2. grup) grubu elementidir.
Ancak 3’ten 8’e kadar değerlik elektronu varsa yeni sisteme göre 10 eklenerek grup numarası söylenir.

Yukarıdaki tabloda periyodik sistemdeki ilk 20 elementin elektronlarının, enerji düzeylerine göre dağılımları görülmektedir. Elementin elektronlarının bulunduğu enerji düzeyi sayısı elementin periyot numarasını, kırmızı renkli olarak yazılan son enerji düzeyindeki elektron sayısı da elementin grup numarasını verir.