ROSI Gerçeği
Geçtiğimiz sene Japon bilim adamlarının yuvarlak spermatid kullanarak, yani ROSI tekniği ile sağlıklı çocukların doğduğunu duyurması, tüm dünyada büyük yankı uyandırdı. Ancak bu uygulama, üzerinde dikkatle durulması gereken çok önemli soru işaretlerini de birlikte getirdi. Her şeyden önce TESE’ye alınan çiftlerin sadece %2’sinde gebelik sağlayabildiği bilinmelidir.
ROSI, henüz kuyruk çıkarmamış ve spermatid adı verilen yuvarlak sperm hücrelerinin tüp bebekte kullanılmasıdır. Oysa olgun sperm hücresi kuyruk taşıyan ve oval yapıda hücreler olup spermatozoa olarak adlandırılırlar. İşte, yuvarlak spermatidlerin kuyruklu spermatozoaya doğru gelişmesi spermiyogenez olarak bilinir ve sperm bu şekilde
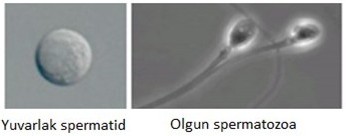 en olgun yapısına kavuşur. Bir başka ifadeyle, spermatidler henüz tam olgunlaşmamış hücrelerdir. Dolayısıyla yumurtayı dölleme ve gebelik başarıları da daha düşük olur. Bundan da önemlisi, sağlıklı embriyo gelişmesinden sorumlu bazı genetik kazanımlardan da eksik kalırlar. Netice olarak ROSI tekniği gerek gebelik başarısının düşük kalması gerekse embriyo gelişimindeki riskleri nedeniyle henüz azoosperminin kanıtlanmış, güvenilir bir kurtarıcısı olarak görülmemeli. Bunu biraz detaylı gözden geçirmekte fayda var.
en olgun yapısına kavuşur. Bir başka ifadeyle, spermatidler henüz tam olgunlaşmamış hücrelerdir. Dolayısıyla yumurtayı dölleme ve gebelik başarıları da daha düşük olur. Bundan da önemlisi, sağlıklı embriyo gelişmesinden sorumlu bazı genetik kazanımlardan da eksik kalırlar. Netice olarak ROSI tekniği gerek gebelik başarısının düşük kalması gerekse embriyo gelişimindeki riskleri nedeniyle henüz azoosperminin kanıtlanmış, güvenilir bir kurtarıcısı olarak görülmemeli. Bunu biraz detaylı gözden geçirmekte fayda var.
TESE’de yuvarlak spermatid varsa, olgun sperm hücresi de bulunmalı
St Luke’s Hospital’dan Dr. Silber ve Dr. Johnson 125 azoospermik erkekte testis dokusunu incelediklerinde, hiç birisinde tek başına yuvarlak spermatid bulamadılar; yuvarlak spermatid varsa, testisin bir yerinde olgun, kuyruk gelişimi başlamış spermler de bulunmaktaydı (Slber 1998). Bir diğer ifadeyle yuvarlak spermatid aşamasında duraklama şeklinde bir patolojik grup yoktu. Benzer şekilde Almanya’dan Dr. Shulze de 766 azoospermik erkekte testis biyopsisi yaptığında sadece 7’sinde yani %1’den de azında tek başına yuvarlak spermatid bulabildi, geri kalanında mutlaka daha gelişmiş sperm hücreleri vardı (Shulze 1999). Belçika’da Brussels Free University’de Verheyen ve arkadaşları ise TESE sırasında testis doku örneklerini incelediklerinde hiç yuvarlak spermatide rastlamadılar. Onlar da yuvarlak spermatid buldukları olgularda mutlaka daha olgun, kuyruklu sperm olacağını bildirmekteler (Verheyen 1998). Kendi gözlemlerimiz de, yuvarlak spermatid olan olguların çoğunda kuyruklu olgun sperm de bulunabileceği yönündedir.
Bütün bu çalışmalar göstermekte ki, ROSI yapmak için sadece yuvarlak spermatid hücreleri bulunmuşsa, daha dikkatli bir araştırma yapılsa dokunun bir yerlerinde daha olgun, kuyruklu sperm hücreleri de bulunabilir. Dolayısıyla gebelik şansı düşük yuvarlak spermatidlerle ROSI yapılacağına, gebelik başarısı çok daha yüksek olgun spermlerle tüp bebek yapılabilecektir. Bu da TESE ameliyatının daha dikkatli ve bilinçli yapılması ile sağlanabilir. Gerçekten de, mikroskop altında, uzun zaman harcayarak yapılan mikroTESE ameliyatlarının olgun sperm bulmadaki başarısı daha fazla olmaktadır. Doku örneklerinde olgun, kuyruklu sperm bulunmasında laboratuvarda embriyoloğun başarısı da çok önemlidir.
ROSI öncesi erkeğin tedavi edilmesi olgun sperm bulma şansını artırabilir
Testislerde sperm üretiminin bozulduğu nonobstrüktif azoospermi (NOA) olgularında erkeğin hormonal tedavisinin, olgun sperm çıkma şansını artırdığı çok sayıda çalışmada gösterilmiştir (Selman 2006, Barbotin 2016, Hussein 2005, Hussein 2013). Özellikle de kuyruk çıkarmamış sperm hücreleri bu tedavilerden fayda görmekte. Erkekte FSH hormonu yüksek olsa da bu tür tedaviler sonuç vermekte. Örneğin Japonya Yamaguchi University’den bir grup araştırıcı FSH’sı yüksek olan ve TESE ile sperm çıkmayan erkeklerde gonadotropin tedavisi ile beşte birinde (%21) olgun, kuyruklu sperm elde ettiklerini bildirdiler (Shiraishi 2012). Araştırıcılara göre testislerinde spermatid olan erkekler bu tedaviden daha fazla fayda sağlamaktaydı (Shiraishi 2016). Eğer testislerde kök hücrelerin çoğalma kapasitelerini gösteren PCNA markırına bakılarak bir tedavi planlanırsa, olgun sperm elde etme olasılığı daha artacaktır (Shinjo 2013). Gonadotropin tedavisi menide bile sperm çıkmasını sağlayabilir (Cocci 2017, Kobori 2015, Selman 2004). Testislerinde sperm üretimi bozuk olan ve testosteron/estradiol denge bozukluğu saptanan azoospermik erkeklerde aromataz inhibitörleri de bir diğer tedavi seçeneğidir (Cavallini 2013). Dolayısıyla, ROSI yapmadan önce erkeğin bir süre tedavi alması, gebelik başarısı düşük spermatidlerle ROSI yapılması yerine, şansı daha iyi olan olgun spermler elde ederek tüp bebeğe geçilmesini sağlayabilir. En azından ROSI de yapılsa, spermatidlerin gebelik başarısını artırıcı bir etkisi olabilir.
ROSI, sağlıklı embriyo gelişiminde bir risk oluşturabilir
Yuvarlak spermatid kullanımındaki en önemli endişe, bu hücreler henüz tam olgunlaşmadıkları için embriyo gelişiminde ve belki de çocukta bazı anomalilere yol açma olasılığıdır. Burada sorun değişik seviyelerden kaynaklanabilir:
Imprinting (damgalanma) bozukluğu:
Normalde hücrelerimizde anneden ve babadan gelen 23’er kromozomun karışımından ibaret 46 kromozom bulunur. Yuvarlak spermatidden olgun sperme doğru geçerken, kromozom sayısı tekrar yarı yarıya azalır ve 23’e iner. Daha sonra spermden gelen 23 kromozom yumurtadaki 23 kromozomla birleşerek, normal hücrelerdeki 46 kromozoma kavuşulur. Ancak spermatidlerde, bu 23 kromozomdaki bazı genlerin üzerine metil molekülleri bağlanarak bu genler susturulur. Böyle genlere imprinte olmuş yani damgalanmış genler denilir.
Damgalanma, ileride sağlıklı embriyo gelişiminde son derece büyük öneme sahiptir. Eğer bu damgalanma yetersiz olursa, embriyoda bazı bozukluklar ortaya çıkabilir. İşte, ROSI’de kullanılmak üzere yuvarlak spermatid seçilirken, şayet henüz damgalanma işlemini yapmamış hücreler seçilirse, bunlardan gelişecek embriyolarda da bozukluklar görülebilir; ya hiç embriyo gelişmez ya da sağlıksız gelişebilir (Tesarik 1998). Imprinting ya da metilesyon yetersizliklerinin çocukta ciddi problemlere yol açtığı bilinmektedir (Gosden 2003, Manning 2001). Nadir de olsa spermatid kullanımı benzer genetik anomalilere neden olabilir (Zech 2000). Ayrıca genetik anomalili spermatidler kullanıldığında, babadan gelen bu kusurların çocuğa geçme konusu da henüz tartışmalıdır (Tesarik 1999).
Spermatid DNA hasarları:
Olgun sperm hücresinde kromozomlar sıkı bir yumak oluştururlar. Kondansasyon denilen bu aşama sayesinde de spermin genetik malzemesi, çevreden gelecek zararlı etkenlerden korunmuş olur. Aksi takdirde DNA hasarı ortaya çıkar ki bu da gebelik şansını ve embriyo sağlığını ciddi şekilde tehdit eder. Kondansasyon işlemi spermatid aşamasında başlar. Bunun için kromozom sarmallarını bir arada tutan histon proteinleri gider ve yerine protamin proteinleri gelir. Bazı yayınlarda aksi bildirilmekle birlikte, yapılan çalışmalar yuvarlak spermatidlerde henüz bu histon-protamin değişiminin tamamlanmadığını ortaya koymuştur. Dolayısıyla bu hücrelerde DNA hasarı yüksek oranda görülür. Kromozomların bu şekilde bozuk yapılanması, embriyo gelişimine de yansıyabilir (Jurisicova 1999, Francavilla 2001).
Spermatid sentrozom bozuklukları:
Normalde sperm yumurta ile birleştikten sonra bölünmeye başlar ve milyonlarca bölünme sonrasında çocuk dünyaya gelir. Hücrelerin bölünme işlevi ise sperm tarafından yumurtaya getirilen sentrozom adlı organel sayesinde gerçekleşir. Sentrozom ise sentriol denilen bir çift yapı taşından oluşur. Sentriol yumurtaya girince ikiye bölünür ve aralarında iplikçikler oluşur. Yumurtanın içindeki kromozomlar da bu iplikçiklere tutunarak ikiye ayrılırlar ve neticede hücre de ikiye bölünerek çoğalmış olur. Eğer spermden gelen bu sentrioller kusurlu ise, bölünme gerçekleşemez ya da daha fenası bozuk bölünme olur ki bu da anormal embriyo gelişimiyle sonuçlanır.
Yuvarlak spermatidlerin kullanıldığı ROSI uygulamalarında bu şekilde hatalı bölünme ve anormal embriyo gelişme riski fazladır (Silber 2003). Gerçekten de böyle bir risk söz konusudur. Çünkü sentrioller hem yumurtanın bölünmesini sağlayan iplikçikleri oluştururlar hem de spermin kuyruğunu yaparlar. Eğer bir hücre kuyruk çıkarma aşamasından daha ileri gidememişse, kuyruğu yapan sentriollerde bir bozukluk var demektir. Dolayısıyla bu şekilde bozuk sentriolleri bulunan bir spermatid ile tüp bebek yapıldığında, yumurtanın da bölünerek çoğalması gerçekleşemeyecektir. Çoğalsa bile bozuk bir embriyo gelişimi görülebilir (Rawe 2008). Gelişimleri yuvarlak spermatid aşamasında kalmış sperm hücrelerinde sentrozom ya da sentriollerle ilgili önemli bazı genlerin eksikliği gösterilmiştir. Örneğin Cetn 1, Cep152 ve TSLC1 adlı genler eksikse sperm gelişimi bozulur ve spermler spermatid aşamasında kalır (van der Weyden 2006, Blachon 2008, Avasthi 2013). Eğer kuyruk gelişimi genetik eksikliğe bağlı olarak ortaya çıkmışsa, bu hücreler ile tüp bebek yapıldığında çocukta gelişimsel sorunlarla karşılaşma riski vardır. Bunlardan birisi Bbs2 gen eksikliğidir. Bbs2 eksikliği spermlerde kuyruk gelişimini engeller ve böyle spermler kuyruk çıkarmamış spermatidler şeklinde bulunur. Bu genin eksikliğinde aynı zamanda obezite, görme bozukluğu, genital sistemde gelişim geriliği, parmak anomalileri, böbrek ve kalp hastalıkları ile birlikte seyreden Bardet–Biedl syndrome (BBS) adı verilen bir hastalık tablosu ortaya çıkar (Nishimura 2004).
Bununla birlikte az sayıda gen gösterilmiştir ki, bunların eksikliği sperm üretimini yuvarlak spermatid seviyesinde durdurur ancak fertilizasyon potansiyelini engellemez. Bunlardan biri CREM (cyclic AMP-responsive element modülatör) adlı gendir. Eksikliğinde kuyruk çıkarmamış spermatid oluşur ama daha olgun hale geçemezler. Bunlar deneysel çalışmalarda yumurta içine verildiklerinde sağlıklı yavrular dünyaya gelmiştir (Yanagimachi 2004). Ancak başka çalışmalarda bu uygulamadan doğacak yavruların da testislerinde gerek yapısal gerekse fonksiyonel anomaliler gelişebileceği gösterildi (Nantel 1996). Kendi gözlemlerimiz ise CREM varlığında da spermatidlerin ileri gelişim aşamasına geçemeyebileceğini ortaya çıkarmıştır. Yani burada sadece CREM değil, başka genetik faktörler de sorumlu olabilir. Zaten yuvarlak spermatid enjeksiyonu ile sağlıklı çocukların dünyaya geldiğini bildiren Tanaka ve ark.’nın (2015) da endişesi, henüz bilemediğimiz başka genlere ya da bunların fonksiyonlarına ait eksikliklerin ileriki yaşlarda çocukta başka sorunlara yol açıp açmayacağıdır.
Yumurtayı aktive edici faktör eksikliği:
Sperm hücresi yumurtaya girerken, beraberinde getirdiği oosit aktive edici faktörleri de taşır. Bu faktörler yumurtanın bölünmesini başlatır. Çünkü yumurta, mayoz bölünmesinin metafaz II aşamasında durur halde bekler. Bunu yapan da metafaz başlatan faktör yani MPF adlı bir proteindir. İşte sperm içerisindeki bazı faktörler bu MPF’yi baskılayarak yumurtada bölünmeyi başlatır. Bu sırada yumurtanın içinde kalsiyum artar (kalsiyum salınımı; oscillation). İnsanda yuvarlak spermatidlerde oosit aktive edici faktörler oluşmaya başlamıştır ancak erken safhalarında henüz yeterli düzeye ulaşmamış olabilir. Yumurtanın bu şekilde uyarılmasındaki bozukluklar da embriyoda genetik sorunlara yol açabilir (Vloeberghs 2013). Bu nedenle de ROSI yapılırken yumurtanın elektrik akımıyla ya da kalsiyum ionophore, phosphatidyl inositol, phospholipase C gibi bazı kimyasal ajanlarla uyarılması önerilir (Tanaka 2015).
Bütün bu faktörler dikkate alındığında ROSI ile tüp bebek uygulaması, üzerinde etraflıca düşünülmesi gereken bir tedavi olarak karşımıza çıkmakta. ROSI yapılacak hasta grubu testislerinde sperm üretimi bozulmuş, yani nonobstrüktif azoospermili (NOA) erkeklerdir. Böyle olgularda tedavi planı yaparken, ileride dünyaya gelecek çocuğun sağlığını gözeten, güvenilirliği bilimsel olarak kanıtlanmış basamakların izlenmesi çok önemlidir.
ROSI’den önce önerilen tedavi planı
-
Tüp bebek öncesi 6 ay süreyle tedavi yapılarak testislerde sağlıklı ve olgun sperm oluşmasına uğraşmak. Bu sırada tüm genetik taramalarının da yapılarak bir sorun olmadığı ortaya konulmalı.
-
Ejakulatta, testislerde sperm oluştuğuna dair markırların çıkmasını beklemek.
-
Dikkatli ve detaylı bir mikroTESE ameliyatı
-
Çıkan dokuların dondurularak saklanması
-
Bu dokuda ileri genetik araştırmalar yaparak sperm serisi hücre aranması ve embriyoda ortaya çıkabilecek olası genetik riskleri araştırmak
-
Sonra eşinin hazırlanarak tüp bebeğe geçilmesi ve dondurulmuş testis dokusunun çözülerek içinde sperm hücresi aranması, mümkünse olgun, kuyruklu sperm kullanılması.
-
Spermatid kullanılırsa embriyo biyopsisi yapılması.
-
Gebelik oluşursa yakın takibi ve gerekirse amniyosentez ile fötusun sağlığının kontrol edilmesi
-
Doğum ve doğum sonrası yakın takip.
Özet
-
ROSI yani yuvarlak spermatidlerin tüp bebekte kullanılması henüz araştırma safhasındadır. Az sayıda örnekte nonobstrüktif azoospermi olgularında %2 oranında gebelikle sonuçlanabileceği gösterilmiştir. Gebelik yapabilecek spermatidlerin ise mutlaka haploid yapıda olması ve genetik bir kusurunun bulunmaması gerekir. Bu hücrelerin de doğrudan kullanılması embriyo gelişimini başlatamayabilir. Ancak önce dondurulup, çözdükten sonra tüp bebekte kullanılması daha etkili görülmekte. Bu nedenle de azoospermi olgularında eşlerin hazırlanmadan önce erkeğe mikroTESE yapılması, çıkan dokunun saklanması ve tüm genetik taramalarının yapıldıktan sonra eşinin hazırlanarak tüp bebeğe geçilmesi tercih edilmelidir.
-
Testiste sadece yuvarlak spermatidlerin bulunup, daha olgun kuyruklu normal spermlerin bulunmadığı olgu sayısı çok nadirdir. Eğer spermatid bulunduysa, testisin başka yerlerinde kuyruklu spermlerin de bulunması mümkündür. Bu nedenle mikroTESE ameliyatı çok titiz bir şekilde yapılmalı, testisler detaylı olarak araştırılmalıdır. Spermatid görülünce taramanın kesilip bunlarla tüp bebek yapılırsa gebelik şansı %2 olacakken, daha dikkatli bir araştırma ile kuyruklu spermlerin bulunması durumunda gebelik başarısı %50’ye kadar çıkabilir.
-
Spermatidler, tedavi ile olgun sperm halinde gelişebilirler. Olgun spermlerin başarısı ise çok daha yüksektir. Dolayısıyla TESE’den önce erkeğin en az 3-6 ay uygun protokollerle tedavi edilmesi gebelik şansını artıracaktır.
-
Testislerde olgun sperm geliştiğinin bir göstergesi de ejakulatta bazı markırların gösterilmesidir. TESE öncesi erkeğin tedavisi sırasında ejakulatta PCNA, ESX, TEX101, haploid hücre gibi markırların araştırılması ve bunlar çıktığında TESE’ye geçilmesi daha faydalı olabilir. Haploid yapıda olgunluğa erişmiş sperm hücrelerini doğrudan seçecek bir tekniğin kullanılması en sağlıklı çözüm olacaktır.
-
ROSI işleminde esas sıkıntı genetik bir bozukluğa bağlı çocukta ortaya çıkabilecek sorunlardır. Bu nedenle işlem öncesi sperm hücrelerinin, işlem sonrasında da embriyoların genetik taramaları yapılmalıdır. Gebelik süreci çok dikkatli takip edilmeli, gerekirse amniyosentez yapılabileceği kabul edilmelidir. Her ne yapılırsa yapılsın, çocukta henüz bilemediğimiz nedenlerden dolayı bir anomalinin gelişebileceği de göze alınmalıdır.
-
Bütün bunların yanı sıra, ROSI ile tüp bebek azoosperminin tedavisinde umut veren bir adımdır. Zamanla gerekli önlemlerin alınması ileride bunu güvenilir bir tedavi alternatifi haline getirebilir. Bu konuda çalışan tüm bilim insanlarına teşekkür ederiz.
Kaynaklar
Avasthi, P., Scheel, J. F., Ying, G., Frederick, J. M., Baehr, W., & Wolfrum, U. (2013). Germline deletion of Cetn1 causes infertility in male mice. Journal of Cell Science, 126, 3204–3213.
Barbotin AL, Ballot C, Sigala J, Leroy M, Rigot JM, Dewailly D, Robin G, Mitchell V. Pregnancy after intracytoplasmic sperm injection following extended sperm preparation and hormone therapy in an azoospermic man with maturation arrest and microlithiasis: a case report and literature review. Andrologia. 2016 Jul 29. doi: 10.1111/and.12665.
Blachon S, Gopalakrishnan J, Omori Y, Polyanovsky A, Church A, Nicastro D, Malicki J, Avidor-Reiss T. Drosophila asterless and vertebrate Cep152 Are orthologs essential for centriole duplication. Genetics. 2008 Dec;180(4):2081-94.
Cavallini G, Biagiotti G, Bolzon E. Multivariate analysis to predict letrozole efficacy in improving sperm count of non-obstructive azoospermic and cryptozoospermic patients: a pilot study. Asian J Androl. 2013 Nov;15(6):806-11.
Cocci A, Cito G, Russo GI, Falcone M, Capece M, Timpano M, Della Camera PA, Morselli S, Tasso G, Morelli G, Morgia G, Minervini A, Serni S, Carini M, Natali A, Gacci M. Effectiveness of highly purified urofollitropin treatment in patients with idiopathic azoospermia before testicular sperm extraction. Urologia. 2017 Aug 7:0. doi: 10.5301/uj.5000253.
Francavilla S, Bianco MA, Cordeschi G, D’Abrizio P, De Stefano C, Properzi G, et al. Ultrastructural analysis of chromatin defects in testicular spermatids in azoospermic men submitted to TESE-ICSI. Hum Reprod. 2001;16(7):1440-8.
Gosden R, Trasler J, Lucifero D and Faddy M. Rare congenital disorders, imprinted genes, and assisted reproductive technology. Lancet 2003; 361: 1975-7.
Hussein, A., Ozgok, Y., Ross, L., & Niederberger, C. (2005). Clomiphene administration for cases of nonobstructive azoospermia: A multicenter study. Journal of Andrology, 26, 787–791; discussion 792–793.
Hussein, A., Ozgok, Y., Ross, L., Rao, P., & Niederberger, C. (2013). Optimization of spermatogenesis-regulating hormones in patients with non-obstructive azoospermia and its impact on sperm retrieval: A multicentre study. BJU International, 111, E110–114.
Jurisicova A, Lopes S, Meriano J, Oppedisano L, Casper RF, Varmuza S. DNA damage in round spermatids of mice with a targeted disruption of the Pp1cgamma gene and in testicular biopsies of patients with nonobstructive azoospermia. Mol Hum Rep. 1999;5(4):323-30.
Kobori Y, Suzuki K, Iwahata T, Shin T, Sato R, Nishio K, Yagi H, Arai G, Soh S, Okada H. Induction of spermatogenesis by rhFSH for azoospermia due to spermatogenic dysfunction with maturation arrest: five case series. Syst Biol Reprod Med. 2015 Jun;61(3):168-70.
Manning M, Lissens W, Liebaers I, Van Steirteghem A, Weidner W. Imprinting analysis in spermatozoa prepared for intracytoplasmic sperm injection (ICSI) International Journal of Andrology 2001; 24: 87.
Nantel F, Monaco L, Foulkes NS, Masquilier D, LeMeur M, Henriksén K, Dierich A, Parvinen M, Sassone-Corsi P. Spermiogenesis deficiency and germ-cell apoptosis in CREM-mutant mice. Nature. 1996 Mar 14;380(6570):159-62.
Nishimura, D. Y., Fath, M., Mullins, R. F., Searby, C., Andrews, M., Davis, R., Andorf, J. L., Mykytyn, K., Swiderski, R. E., Yang, B. et al. (2004). Bbs2-null mice have neurosensory deficits, a defect in social dominance, and retinopathy associated with mislocalization of rhodopsin. Proc. Natl. Acad. Sci. USA 101, 16588-16593.
Rawe, V. Y., Díaz, E. S., Abdelmassih, R., Wójcik, C., Morales, P., Sutovsky, P., Chemes, H. E. (2008). The role of sperm proteasomes during sperm aster formation and early zygote development: Implications for fertilization failure in humans. Human Reproduction, 23, 573–580.
Schulze W, Thoms F, Knuth UA. Testicular sperm extraction: comprehensive analysis with simultaneously performed histology in 1418 biopsies from 766 subfertile men. Hum Reprod. 1999;14:82-96.
Selman H, De Santo M, Sterzik K, Cipollone G, Aragona C, El-Danasouri I. Rescue of spermatogenesis arrest in azoospermic men after long-term gonadotropin treatment. Fertil Steril. 2006 Aug;86(2):466-8.
Selman, H. A., Cipollone, G., Stuppia, L., De Santo, M., Sterzik, K., & El-Danasouri, I. (2004). Gonadotropin treatment of an azoospermic patient with a Y-chromosome microdeletion. Fertility and Sterility, 82, 218–219.
Shinjo E, Shiraishi K, Matsuyama H. The effect of human chorionic gonadotropin-based hormonal therapy on intratesticular testosterone levels and spermatogonial DNA synthesis in men with non-obstructive azoospermia. Andrology. 2013 Nov;1(6):929-35.
Shiraishi K, Ishikawa T, Watanabe N, Iwamoto T, Matsuyama H. Salvage hormonal therapy after failed microdissection testicular sperm extraction: A multi-institutional prospective study. Int J Urol. 2016 Jun;23(6):496-500.
Shiraishi K, Ohmi C, Shimabukuro T, Matsuyama H. Human chorionic gonadotrophin treatment prior to microdissection testicular sperm extraction in non-obstructive azoospermia. Hum Reprod. 2012 Feb;27(2):331-9.
Silber S, Escudero T, Lenahan K, Abdelhadi I, Kilani Z, Munne S. Chromosomal abnormalities in embryos derived from testicular sperm extraction. Fertil Steril. 2003;79(1):30-8.
Silber SJ, Johnson L. Are spermatid injections of any clinical value? ROSNI and ROSI revisited. Human Reproduction. 1998;13(3):509-15.
Tanaka A, Nagayoshi M, Takemoto Y, Tanaka I, Kusunoki H, Watanabe S, Kuroda K, Takeda S, Ito M, Yanagimachi R. Fourteen babies born after round spermatid injection into human oocytes. Proc Natl Acad Sci U S A. 2015 Nov 24;112(47):14629-34.
Tesarik J, Bahceci M, Ozcan C, Greco E, Mendoza C. In-vitro spermatogenesis – Reply. Lancet. 1999;353(9165):1708
Tesarik J, Greco E, Cohen-Bacrie P, Mendoza C. Germ cell apoptosis in men with complete and incomplete spermiogenesis failure. Mol Hum Reprod. 1998;4(8):757-62.
van der Weyden L, Arends MJ, Chausiaux OE, Ellis PJ, Lange UC, Surani MA, Affara N, Murakami Y, Adams DJ, Bradley A. Loss of TSLC1 causes male infertility due to a defect at the spermatid stage of spermatogenesis. Mol Cell Biol. 2006 May;26(9):3595-609.
Verheyen G, Crabbe E, Joris H, Van Steirteghem A. Simple and reliable identification of the human round spermatid by inverted phase-contrast microscopy. Hum Reprod. 1998;13(6):1570-7,
Vloeberghs V, Verheyen G, Tournaye H. Intracytoplasmic spermatid injection and in vitro maturation: fact or fiction? Clinics (Sao Paulo). 2013;68 Suppl 1:151-6.
Yanagimachi R, Wakayama T, Kishikawa H, Fimia GM, Monaco L, Sassone-Corsi P. Production of fertile offspring from genetically infertile male mice. Proc Natl Acad Sci U S A. 2004 Feb 10;101(6):1691-5.
Zech H, Vanderzwalmen P, Prapas Y, Lejeune B, Duba E, Schoysman R. Congenital malformations after intracytoplasmic injection of spermatids. Hum Reprod. 2000;15(4):969-71, http://dx.doi.org/10.1093/humrep/15. 4.969.
 en olgun yapısına kavuşur. Bir başka ifadeyle, spermatidler henüz tam olgunlaşmamış hücrelerdir. Dolayısıyla yumurtayı dölleme ve gebelik başarıları da daha düşük olur. Bundan da önemlisi, sağlıklı embriyo gelişmesinden sorumlu bazı genetik kazanımlardan da eksik kalırlar. Netice olarak ROSI tekniği gerek gebelik başarısının düşük kalması gerekse embriyo gelişimindeki riskleri nedeniyle henüz azoosperminin kanıtlanmış, güvenilir bir kurtarıcısı olarak görülmemeli. Bunu biraz detaylı gözden geçirmekte fayda var.
en olgun yapısına kavuşur. Bir başka ifadeyle, spermatidler henüz tam olgunlaşmamış hücrelerdir. Dolayısıyla yumurtayı dölleme ve gebelik başarıları da daha düşük olur. Bundan da önemlisi, sağlıklı embriyo gelişmesinden sorumlu bazı genetik kazanımlardan da eksik kalırlar. Netice olarak ROSI tekniği gerek gebelik başarısının düşük kalması gerekse embriyo gelişimindeki riskleri nedeniyle henüz azoosperminin kanıtlanmış, güvenilir bir kurtarıcısı olarak görülmemeli. Bunu biraz detaylı gözden geçirmekte fayda var.